【免疫染色の工程】抗原賦活・ブロッキング・洗浄・発色・染色不良と解決法を完全解説!

免疫染色の原理は以下の9種類があります。
- 酵素抗体法
- 蛍光抗体法
- 直接法
- 間接法
- ABC法
- LSAB法
- (高分子)ポリマー法
- PAP法
- CSA法
この記事では試験に頻出の
❶酵素抗体法のポリマー法
❷酵素抗体法のABC(LSAB)法
❷蛍光抗体法
の重要工程を詳細解説します。
ぜひ試験対策にお使いください。
高分子ポリマー法の詳細
【高分子ポリマー法の手順】
- 固定
- 脱パラ・脱キシ・親水
- 内因性酵素のブロッキング
(水洗) - 抗原賦活化
(水洗) - PBS洗浄
- 非特異的反応のブロッキング
- 一次抗体反応
(PBS洗浄) - 二次抗体反応
(PBS洗浄) - DABなどで発色
(流水水洗) - マイヤーのヘマトキシリンで核染
- 脱水・透徹・封入
❶【固定液の特徴が重要!】組織や細胞の固定を行う
組織診:10%中性緩衝ホルマリン
細胞診:95%エタノール
そのほか、以下のアルデヒドを含む固定液も有用とされます。
- パラホルムアルデヒド液
PLP液とザンボーニ液の構成要素。 - PLP液
免疫染色に有用であるが、糖鎖抗原の検出には✖︎ - ザンボーニ液
ピクリン酸を含むため組織が硬化しやすい。
免疫染色は固定時間も重要です。
- 乳癌 HER2
6〜72時間 - 肺癌 EGFR
6〜48時間
このように何を行うかによって推奨時間が多少変化します。
2日〜3日と覚えておきましょう。
❷脱パラ・脱キシ・親水
組織の場合はパラフィン包埋されているため、パラフィンを溶かしてから水になじませていきます。
パラフィンとは?
2番目の脱キシはアルコールのことです。
❸【試薬が重要!】内因性酵素のブロッキング
体の中にはもともとペルオキシダーゼ(POD)やアルカリホスファターゼ(ALP)などの酵素が存在します。
この酵素を除去しないと余計な部分にも反応してしまうため、工程の序盤で除去します。
以下の図はPODを用いた免疫染色の場合のブロッキング方法です。
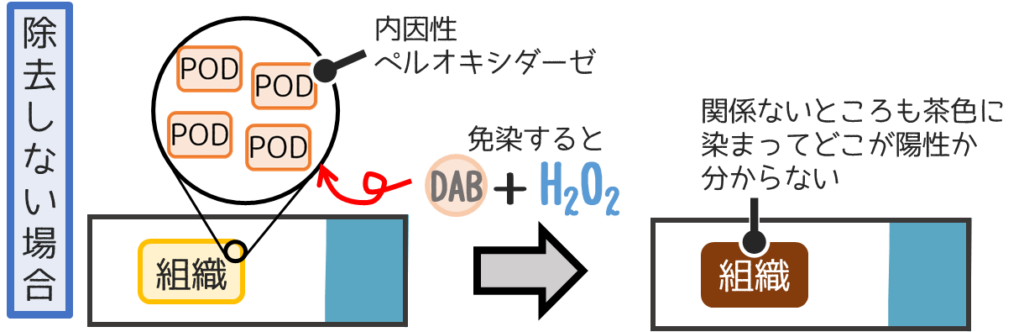
このままではすべてが染まってしまい、どこが目的の場所か分かりません
そこで内因性PODを除去すると・・・
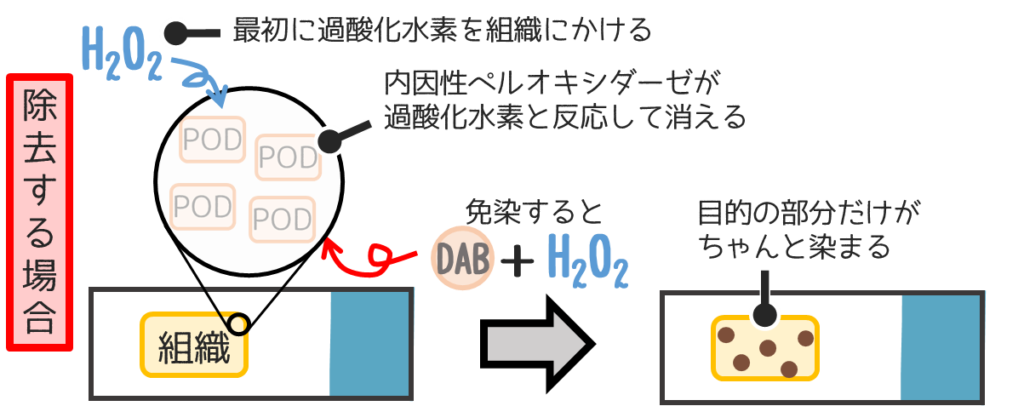
除去したい内因性酵素の種類によって使用する試薬は異なります。
- 内因性POD
好中球、好酸球、赤血球などに多く、アルコール固定標本の方がホルマリン固定標本より活性が高い。
【除去試薬】- 過酸化水素
- 過酸化水素加メタノール
- 過ヨウ素酸
- アジ化ナトリウム
- 内因性ALP
ホルマリン固定パラフィン包埋切片では影響がなく、細胞診標本や凍結切片では必要。体腔液中の腺癌がもつALPは除去されにくい。
【除去試薬】- レバミゾール
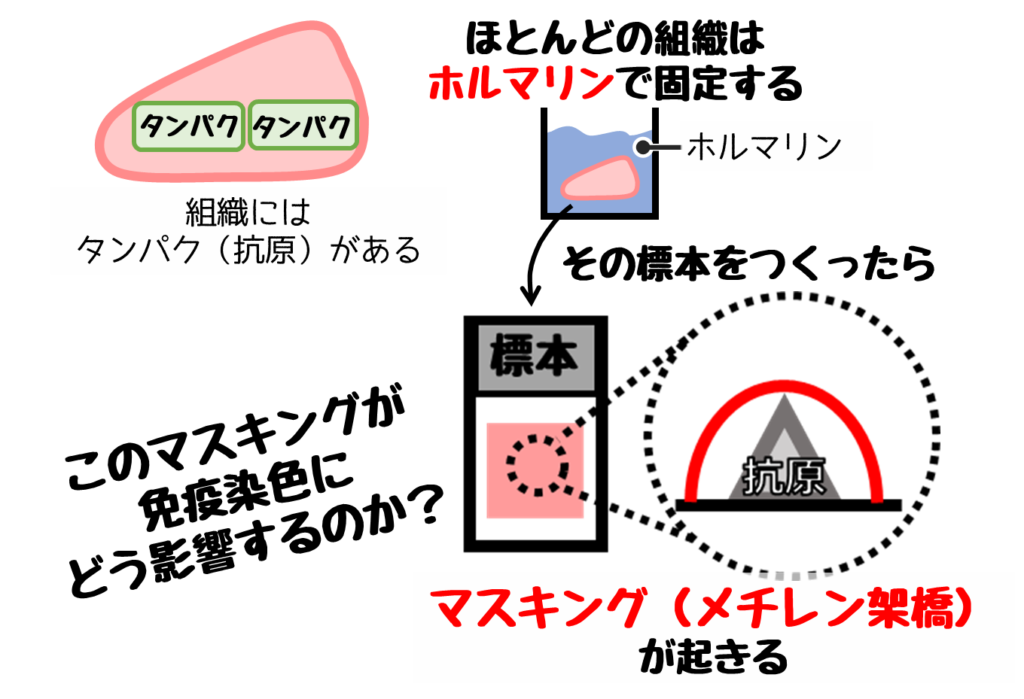
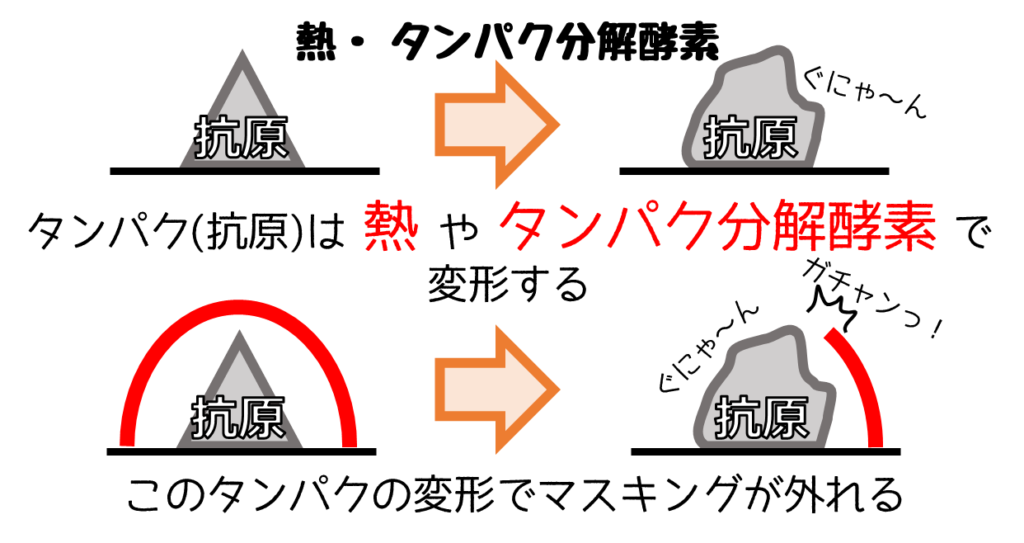
❹【方法と試薬が重要!】抗原賦活化
【抗原の賦活化】とは”抗原と抗体が反応しやすくなるようにすること”です
主な原因はアルデヒド系固定液で生じるメチレン架橋や有機溶剤など。
このような現象はマスキングとも呼ばれ、これを外す作業が【抗原の賦活化】です。
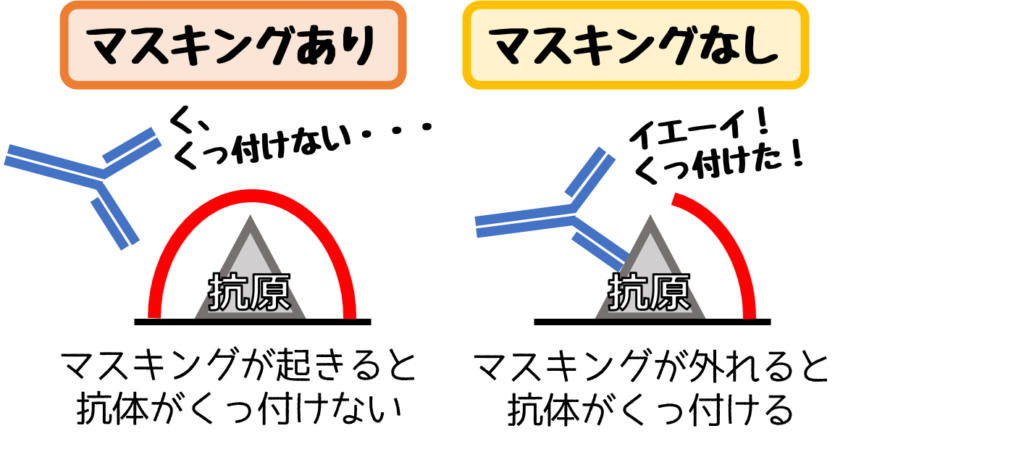
【賦活化の方法】熱処理 or タンパク分解酵素処理
抗原つまりタンパクは熱や酵素によって構造が変化します。
この構造が変化がマスキングを外します。
主に核内抗原の検出時に用いられるもので、以下の加熱方法がある。
- 電子レンジ
- オートクレーブ
- 圧力鍋
- 温浴槽 など
加熱による賦活を行う際は標本を緩衝液(pH6~7クエン酸緩衝液, pH8EDTA, pH9Tris-EDTAのどれか)に漬けた状態で行う。
加熱後、急速に冷やすとMIB-1などの核内抗原が偽陰性化するため室温でゆっくり冷ます必要がある。
主に細胞質抗原の検出に用いられる。
95%エタノール固定の細胞診検体にはあまり使わない。
以下の酵素がある。
- トリプシン
- ペプシン
- プロテイナーゼK など
この処理を行うことで免疫染色が可能になります。

❺PBS洗浄
抗体との反応が近づいてきたら水は使わず、PBS(リン酸緩衝生理食塩水)を使います。
各洗浄が不十分だとバックグラウンドが高くなるなどの不具合が生じます。
逆にやりすぎると、陽性反応が薄くなることもあります。
そのため、洗浄操作は非常に重要な工程の1つです。
洗浄力を上げる方法もあり、問題として出題されることがあります。
- 洗浄回数を増やす
- 洗浄液にTween 20などの非イオン性界面活性剤の添加
- 洗浄液にスキムミルクを添加
- 洗浄液のpHや塩濃度を上げる
❻非特異的反応のブロッキング
理想は目的の場所だけに抗体を反応させたいですが、実際は関係ない部分にも反応します。
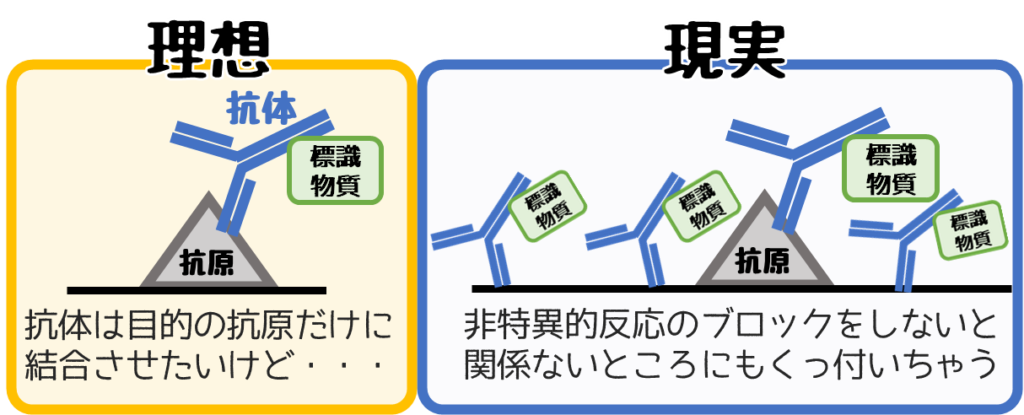
この関係ない部分への反応を抑えるのが【非特異的反応のブロッキング】です。
反応させたい抗体を添加する前にタンパク成分を敷き詰めることでブロックできます。
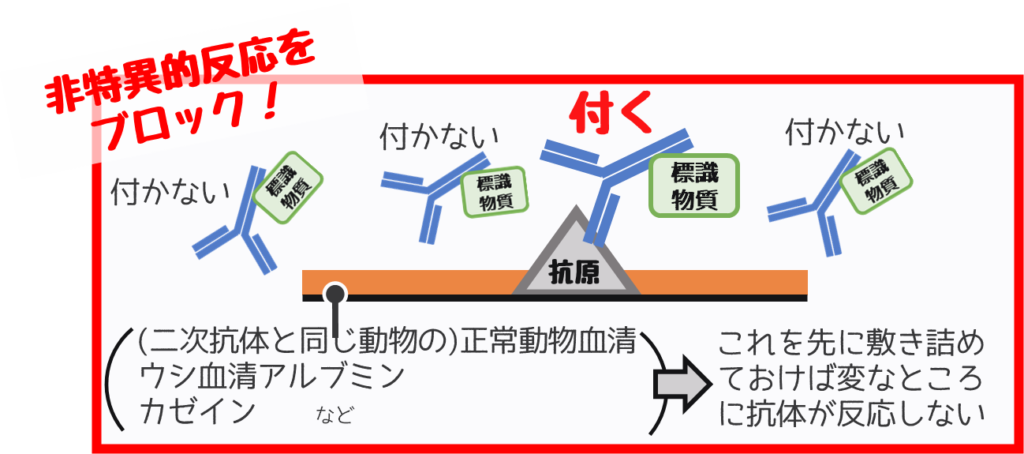
- (二次抗体と同じ動物の)正常動物血清
- ウシ血清アルブミン
- カゼイン など
❼一次抗体反応
目的の抗原にくっ付く一次抗体を反応させます。
反応後、付いてない抗体を除去するためにPBSで洗浄します。
この時に洗浄が不十分だと、非特異的な反応が増え偽陽性になるため注意。
❽二次抗体反応
ポリマー法では高分子ポリマーが結合した二次抗体を反応させます
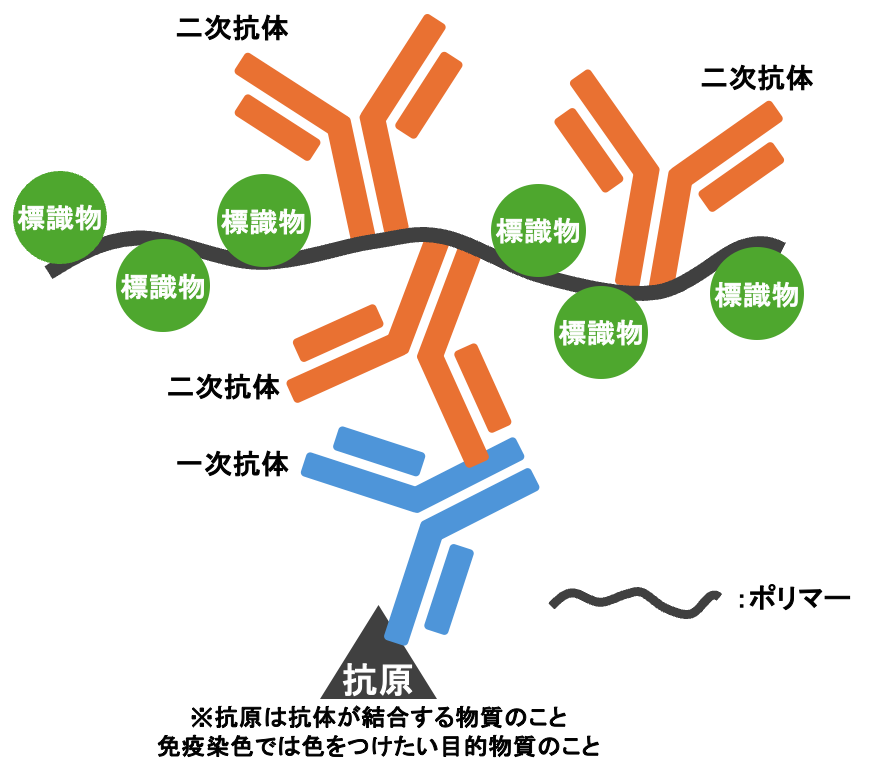
反応後、結合していない抗体をPBSで洗います。
この時に洗浄が不十分だと、非特異的な反応が増え偽陽性になるため注意。
❾DABやAECで発色
| 酵素 | POD | |
|---|---|---|
| 基質 | DAB | AEC |
| 反応原理 | 酸化 | 酸化 |
| 発色後の色 | 茶色 | 赤色 |
| 封入剤 | 非水溶性 | 水溶性 |
| 永久標本 | なる | ならない |
DAB:ジアミノベンチジン
AEC:アミノエチルカルバゾール
DABは発がん性(膀胱癌など)がある点にも注意。
反応後、発色反応を止めるために流水水洗します。
DAB発色時の増感方法
DABを用いた場合は感度を上げる増感方法が知られています。
- イミダゾール溶液
DAB溶液に添加すると増感される。 - 重金属イオン水溶液
DAB溶液に1%塩化コバルト水溶液、1%塩化ニッケル水溶液、1%硫酸銅水溶液を添加すると、それぞれ暗青色、紫青色、灰青色に発色する。 - クエン酸-酢酸アンモニウム緩衝液
DAB溶解液としてクエン酸-酢酸アンモニウム緩衝液(pH 5.0)を用いる。 - オスミウム酸
DAB発色後に1%オスミウム酸溶液で反応。 - メセナミン銀液
DAB発色後、PAM染色液で反応。
❿マイヤーのヘマトキシリンで核染
免疫染色では進行性のヘマトキシリンで核を染めます
染めたら水洗します。
⓫脱水・透徹・封入
●DABは脱水・透徹して非水溶性封入剤で封入
●AECは脱水せずに蒸留水を通して水溶性封入剤で封入
LSAB(ABC)法
LSAB法とABC法は手順が使用するアビジンの種類が違うだけなので、ここではほぼ同じものとして記載してます。
現在はLSAB法の方が使われると思うので、LSAB法の手順を記載します。
【LSAB法(ABC法)の手順】
- 脱パラ・脱キシ・親水
- 内因性ペルオキシダーゼのブロッキング
(流水水洗) - 抗原賦活化
(流水水洗) - PBS洗浄
- 内因性ビオチンのブロッキング
(PBS洗浄) - 非特異的反応のブロッキング
(PBS洗浄) - 一次抗体反応
(PBS洗浄) - ビオチン化二次抗体反応
(PBS洗浄) - 酵素標識ストレプトアビジン反応
(PBS洗浄) - DABなどで発色
(流水水洗) - マイヤーのヘマトキシリンで核染
- 脱水・透徹・封入

❶〜❹はポリマー法と同じなので省略。
LSAB法に特徴的な❺・❽・❾を確認しよう!
❺内因性ビオチンのブロッキング
内因性ビオチンとはもともと体の中にあるビオチンのことです。
ビオチンとは?
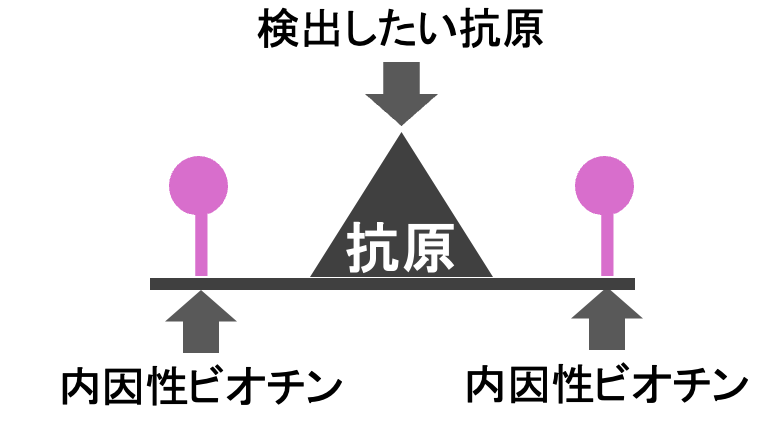
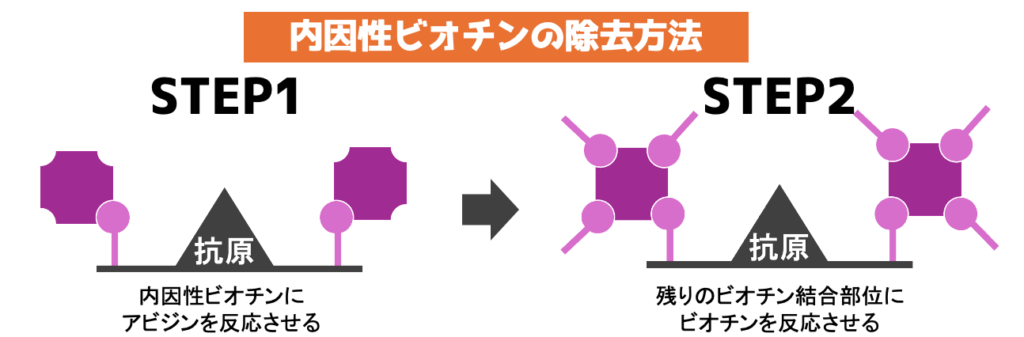
この内因性ビオチンがABC法やLSAB法の時に反応してしまうため、事前に除去する必要がります。
下画像のように事前にアビジンとビオチンを反応させれば除去できます。
アビジンとは?
❺ビオチン化二次抗体反応
ABC法やLSAB法では一次抗体反応後、ビオチンが付いた二次抗体を反応させます。
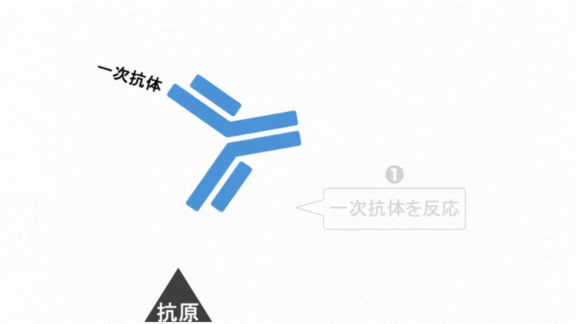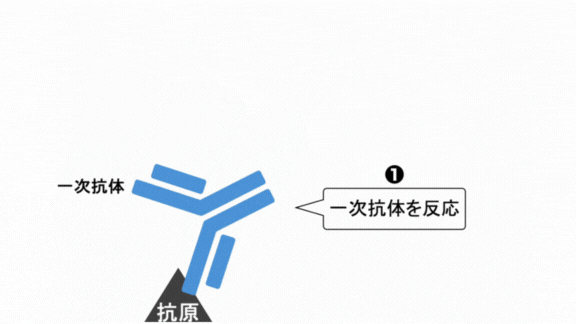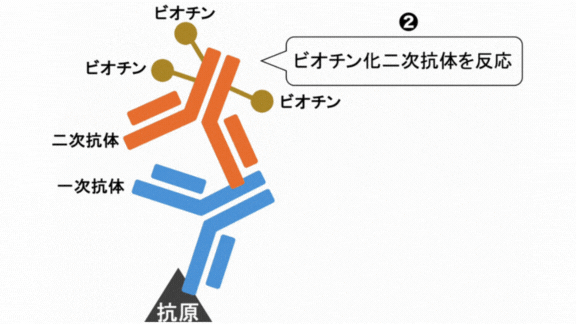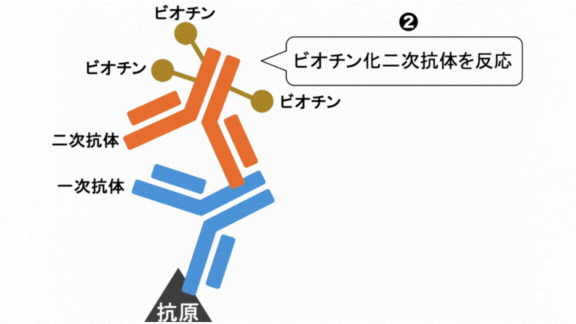
二次抗体反応後は結合していない二次抗体をPBSで洗い流します。
❻酵素標識ストレプトアビジン反応
次にストレプトアビジンを反応させます。
ストレプトアビジンとは?

標識物質をたくさん結合できるため感度が高くなります。
あとはポリマー法と同じようにPBS洗浄した後、DABなどで発色します。
蛍光抗体法
【蛍光抗体法の手順】
- 凍結切片作製
- PBS洗浄
- 非特異的反応のブロッキング
- 一次抗体の反応
(PBS洗浄) - 蛍光標識二次抗体反応【遮光】
(PBS洗浄【遮光】) - 核染色用蛍光試薬の反応【遮光】
(PBS洗浄) - 水溶性封入剤で封入
- 蛍光顕微鏡や共焦点レーザー顕微鏡で観察
❶凍結切片作製
蛍光抗体法は通常のパラフィン切片ではなく凍結切片を使うことが多いです。
凍結切片の方が抗原性が保たれるためです。
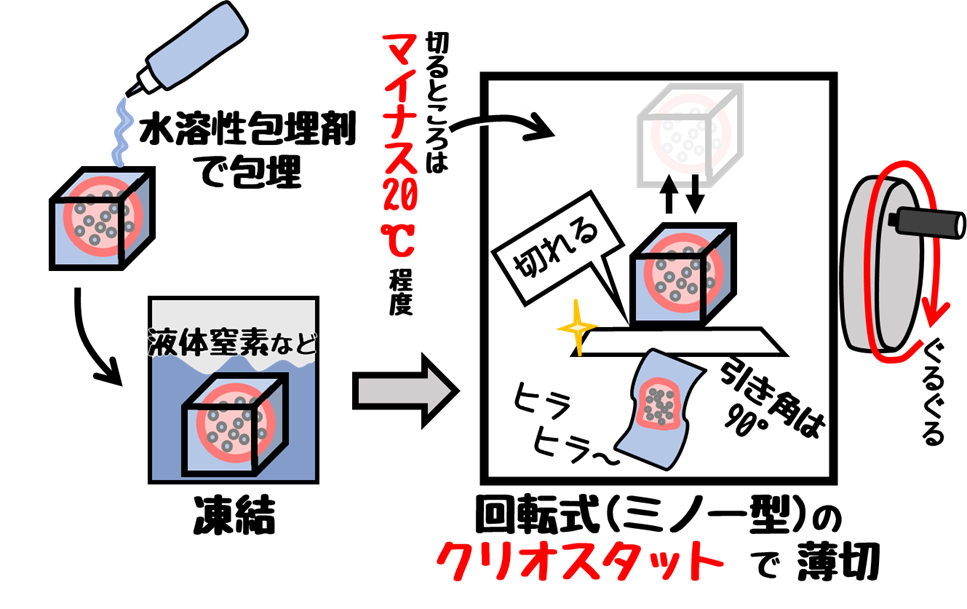
切片をガラスに貼りつけた後、PBSで洗浄します。
その後、他の方法と同じように非特異的反応のブロッキングを行います。
非特異的反応のブロッキングは必要ですが、酵素やビオチンを使わないため、内因性の酵素やビオチンのブロッキングは行いません。
❹一次抗体の反応
非特異的反応のブロッキングが終わったら、他の方法と同様に一次抗体を反応させます。
検査の赤本は間接法が記載されているため、ここでは間接法で説明します。
一次抗体反応後はPBSで洗浄します。
❺蛍光標識二次抗体反応【遮光】
一次抗体に蛍光色素が標識された二次抗体を反応させます。
蛍光は光に弱いため、ここからは遮光して暗い中で操作します。
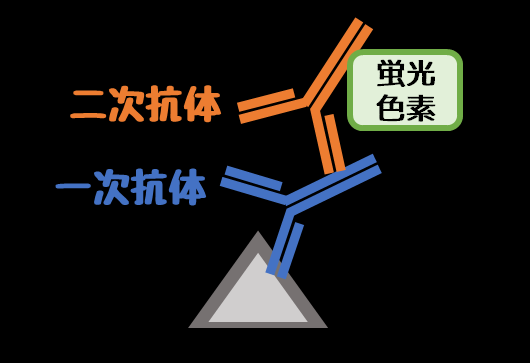
抗体に付ける蛍光色素には種類があるので絶対覚えましょう。
- FITC(緑黄色)
- Cy3(赤橙色)
- Texas red(赤色)
反応後、遮光した状態でPBS洗浄を行います。
❻核染色用蛍光試薬の反応【遮光】
次は核を蛍光色素で染めます。
抗体に標識している蛍光と種類が異なるので気をつけてください。
- DAPI(青)
- Hoechst(青)
- Propidium iodide(赤)
これらの蛍光色素はDNAに直接結合するため核が染まります。
反応後はPBSで洗浄します。
❼水溶性封入剤で封入
蛍光色素を使った標本は水溶性封入剤で封入します。
- 水溶性封入剤
- グリセリン・ゼラチン など
- 非水溶性封入剤
- マリノール
- マウインとクイック など

❽蛍光顕微鏡・共焦点レーザー顕微鏡で観察
蛍光をみるには蛍光観察が可能な顕微鏡を使う必要があります。
この2種類の顕微鏡は蛍光観察が可能です。
励起光という光を当てて蛍光が光る状態にして観察します
免疫染色 不良標本の原因と対処法4選
臨床検査技師国家試験や細胞検査士試験には
「免疫染色時のどんな影響でどんな不良標本ができるか」
が問われます。
免疫染色(PAP法)で陽性コントロールの染色性が低下した。
対処法はどれか。
- 内因性ペルオキシダーゼ不活化時間を長くする
- 一次抗体を濃くする
- 一次抗体反応後の洗浄を長くする
- 二次抗体の反応時間を短くする
- DABの反応時間を短くする
答え:2
この章を見れば、このような問題が解けるようになります。
免疫染色 不良標本の種類は4種類ある
不良標本の種類は主に以下の4種類があります。
- 切片が剥離する
- 染色性が弱い
- バックグラウンド(非特異的反応が強い)
- 染色ムラがある
❶切片が剥離する
切片が剥離する原因は以下の通りです。
原因1
脱脂・脱水・パラフィン浸透不足
- 原因1
脱脂・脱水・パラフィン浸透不足 - 原因2
剥離防止コートスライドを使用していない - 原因3
切片が厚い - 原因4
抗原賦活化による剥離
【解決策】
脱水・脱脂・パラフィン浸透を十分行う
組織の免疫染色は薄切切片を使います。
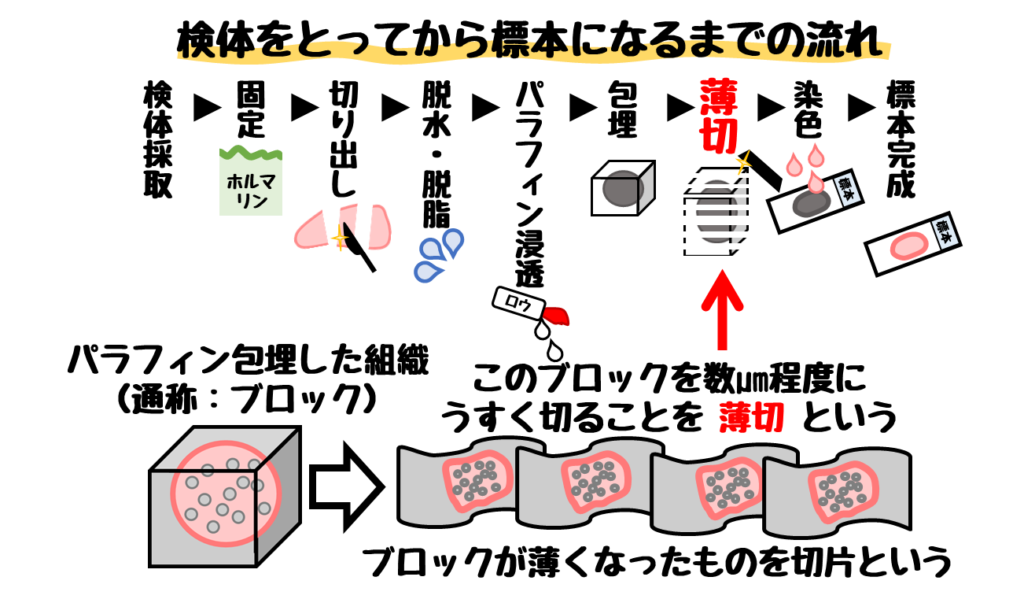
この切片作製の工程にある【脱水・脱脂・パラフィン浸透】が不十分だと良い切片が作製できません。
具体的には❶ガラスから剥がれる❷そもそも薄切できないなどが生じます。
これらの操作を十分に行えば、切片の剥離を防ぐことができます。
【解決策】
コーティングスライドを使用する
切片は最終的にガラスに貼り付けます。
そのガラスには種類があり、免疫染色にはコーティングガラスが最適です。
コーティングは剥離防止のために行われ、様々な種類があります。
以前は卵白を使ったコーティングが行われており、卵白にはアビジンが含まれています。
そのため、卵白コーティング時には非特異的な反応が生じるので注意。
【解決策】
適切な切片厚(3~4µm)で薄切する
切片が厚いとガラスから剥がれやすくなります。
適切な切片の厚さ(3~4µm)で切るとはがれにくくなります。
【解決策】
最適な条件を設定するまたはコートスライドを使う
免疫染色では抗原を賦活化するために熱や酵素で処理します。
この処理によってガラスから剥がれやすくなります。
事前に剥がれない条件を検討する必要があります。
具体的には温度・時間・緩衝液のpHなどを検討します。
❷染色性が弱い
染色性が弱い原因は以下の通りです。
- 原因1
抗体濃度が薄い - 原因2
抗体反応時間が短い - 原因3
抗体や標識物質の失活 - 原因4
抗原性の低下 - 原因5
抗原賦活化法が不適切
【解決策】
抗体濃度を上げる
抗体の濃度が低いと抗原に結合する確率が下がります。
そのため、染色性が薄くなる可能性が上がります。
染色性が弱い時は抗体の濃度を上げてみます。
【解決策】
抗体反応時間を長くする
抗体反応時間が短いと抗体が結合しづらくなります。
染色性が弱い時は反応時間を長くしてみます。
【解決策】
新しい抗体または標識物質を使う
使用する抗体や標識物質が使えなくなっている場合があります。
その場合は新しいものに変えるしかありません。
【解決策】
再薄切、再検体採取などを行う
免疫染色視点の抗原性とは抗原が抗体と結合できる能力のことです。
抗原性が低下すると抗体と結合できなくなります。
抗原性低下の原因として❶切片やブロックの経年劣化❷固定不良❸過固定などがあります。
固定時間は短くても長くてもダメで、検出したい抗原によって推奨時間が異なります。
以下に一部の例を示します。
- 乳癌 HER2
6〜72時間 - 肺癌 EGFR
6〜48時間
【解決策】
最適な賦活化法を検討する
抗原賦活化法が不適切だと抗原が壊れたり賦活されなかったりします。
そうすると抗体が付かず染色性が弱くなります。
そのため、事前に最適な賦活方法を検討することが重要です。
❸バックグラウンド(非特異的反応が強い)
バックグラウンドが高い原因は以下の通りです。
- 原因1
切片が乾燥している - 原因2
ブロッキングをしていない - 原因3
抗体の濃度が高い - 原因4
発色時間が長い - 原因5
洗浄が不十分
【解決策】
常に湿潤状態にして乾燥を防ぐ
免疫染色の途中で乾燥すると、その部分に抗体が吸着し、偽陽性を示します。
そのため免疫染色時は常に湿潤状態にしておく必要があります。
【解決策】
非特異的反応のブロッキングを行う
非特異的反応のブロッキングを行えばバックグラウンドを抑えられます。
「内因性ペルオキシダーゼ不活化の時間を長くする」などもバックグラウンドを抑えられます。
【解決策】
抗体の濃度を下げる
抗体の濃度が高いと関係ない部分にも結合する可能性が上がります。
関係ない部分も染まっている場合は抗体をさらに希釈します。
【解決策】
発色時間を短くする
発色時間とはDABなどの発色基質を反応させる時間のことで、これが長いと関係ない部分にも色が付きます。
染まりすぎる場合はこの時間を短くします。
【解決策】
PBSなどの洗浄を十分に行う
免疫染色の洗浄はPBSやTBSで行います。
この洗浄は余分な抗体などを洗い流す役割ですが、不十分だと余分な抗体が残ります。
残存する余分な抗体に反応し、関係ない部分が染まるため十分に洗浄する必要があります。
洗浄効果を高める以下の方法も検討します。
- 洗浄回数を増やす
- 洗浄液にTween 20などの非イオン性界面活性剤の添加
- 洗浄液にスキムミルクを添加
- 洗浄液のpHや塩濃度を上げる
❹染色ムラがある
染色ムラの原因は以下の通りです。
- 原因1
試薬が全体にかかっていない - 原因2
洗浄が不十分 - 原因3
滴下した試薬に気泡がある - 原因4
切片が部分的に乾燥
【解決策】
試薬をまんべんなくかける
試薬がまばらにかかるとムラができます。
かかっていない部分は染まらなくなるため、ムラがないか確認が必要。
【解決策】
洗浄を十分に行うまたは洗浄力を高める
洗浄が不十分な場合、無駄な抗体がまばらに残りムラになります。
洗浄を十分に行うか、洗浄力を高める必要があります。
- 洗浄回数を増やす
- 洗浄液にTween 20などの非イオン性界面活性剤の添加
- 洗浄液にスキムミルクを添加
- 洗浄液のpHや塩濃度を上げる
【解決策】
気泡があれば潰す
気泡がある場所は試薬がかかっていません。
そのため気泡部分は染まらなくなり、染色結果にムラが生じます。
気泡が確認できた場合は潰しておきましょう。
【解決策】
常に湿潤状態にして乾燥を防ぐ
乾燥してる部分にはその部分に抗体が吸着し、偽陽性を示します。
乾燥していない部分は通常の染まり方をします。
その差がムラとして見られるため、乾燥しないように注意しましょう。
染色不良の問題を解説
免疫染色(PAP法)で陽性コントロールの染色性が低下した。
対処法はどれか。
- 内因性ペルオキシダーゼ不活化時間を長くする
- 一次抗体を濃くする
- 一次抗体反応後の洗浄を長くする
- 二次抗体の反応時間を短くする
- DABの反応時間を短くする
答え:2
1.内因性ペルオキシダーゼ不活化時間を長くする
背景の染まりが強い時に行います。
内因性ペルオキシダーゼのブロッキングは陽性コントロールの染色性と関係ないです。
2.一次抗体を濃くする
一次抗体が薄いと染色性が低下します。
そのため染色性が低下した場合は抗体濃度を濃くします。
3.一次抗体反応後の洗浄を長くする
洗浄を長くするのは染まりが強い時に行います。
洗浄はくっ付いてない余分な抗体などを洗い流す効果があります。
過剰な洗浄は余計反応が薄くなる可能性があります。
4.二次抗体の反応時間を短くする
抗体の反応時間を短くするのは染まりが強い時にします。
反応時間が短いと抗体がくっ付く可能性が下がります。
染まりが強い時は反応を弱めるために時間を短くします。
5.DABの反応時間を短くする
DAB反応時間を短くするのは染まりが強い時にします。
DABは時間が長ければ長いほど染まりが強くなります。
つまり短くするということは色を薄くするということになります。





