免疫染色の原理|酵素・蛍光抗体法、直接法、間接法、ABC法、LSAB法、ポリマー法をわかりやすく解説


この記事では直接法、間接法、ABC法、LSAB法、ポリマー法の原理をイラストで解説していきます!
免疫染色の原理〜タンパク質を可視化する方法〜
免疫染色は通常目で見えないタンパク質に色を付けて見えるようにする技術のことです。
目的としてるタンパクある場合、下右画像のように色(今回は茶色)が付きます。
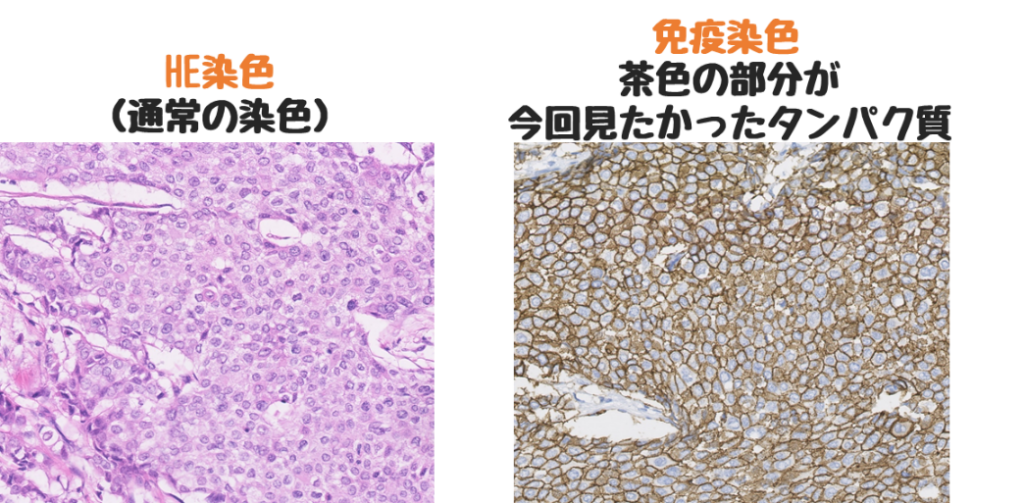
免疫染色は抗原抗体反応をつかう
免疫染色は抗原抗体反応を使って発色させます。
抗原(タンパク)に抗体が特異的に結合する反応。
がん細胞が出す特徴的なタンパクなどを染めることでがん細胞の検出などが可能となる。
抗体は特定のタンパク(抗原)に結合することができます。

この抗体に色が付く工夫をすれば抗原(目的のタンパク)が間接的に染色されることになります。
免疫染色と似た言葉に【免疫組織化学】があります。
結論、これは言い方が違うだけでどちらも同じ意味です。
「この技術は染色ではなく化学反応だ」ということで、免疫染色と呼ぶのはナンセンスと言う先生もいます。
この記事では「免疫染色」の方が文字数が少なく、読みやすくなるので「免疫染色」と記載します。
さらに「免疫”組織”化学(IHC)」と「免疫”細胞”化学(ICC)」がありますが、前者は組織標本、後者は細胞診標本の時に使われる言葉です。
免疫染色は3種類の分け方がある
免疫染色は大まかに3種類の分け方があります。
- 発色方法で分ける
- 使う抗体の数で分ける
- 感度を上げる方法で分ける

❶から順番に確認していこう!
❶発色方法の違いによる分け方
免疫染色の発色方法には大きく2種類あります。
●【酵素抗体法】
酵素と基質で発色
●【蛍光抗体法】
蛍光色素で発色
●酵素抗体法〜酵素と基質で発色する〜
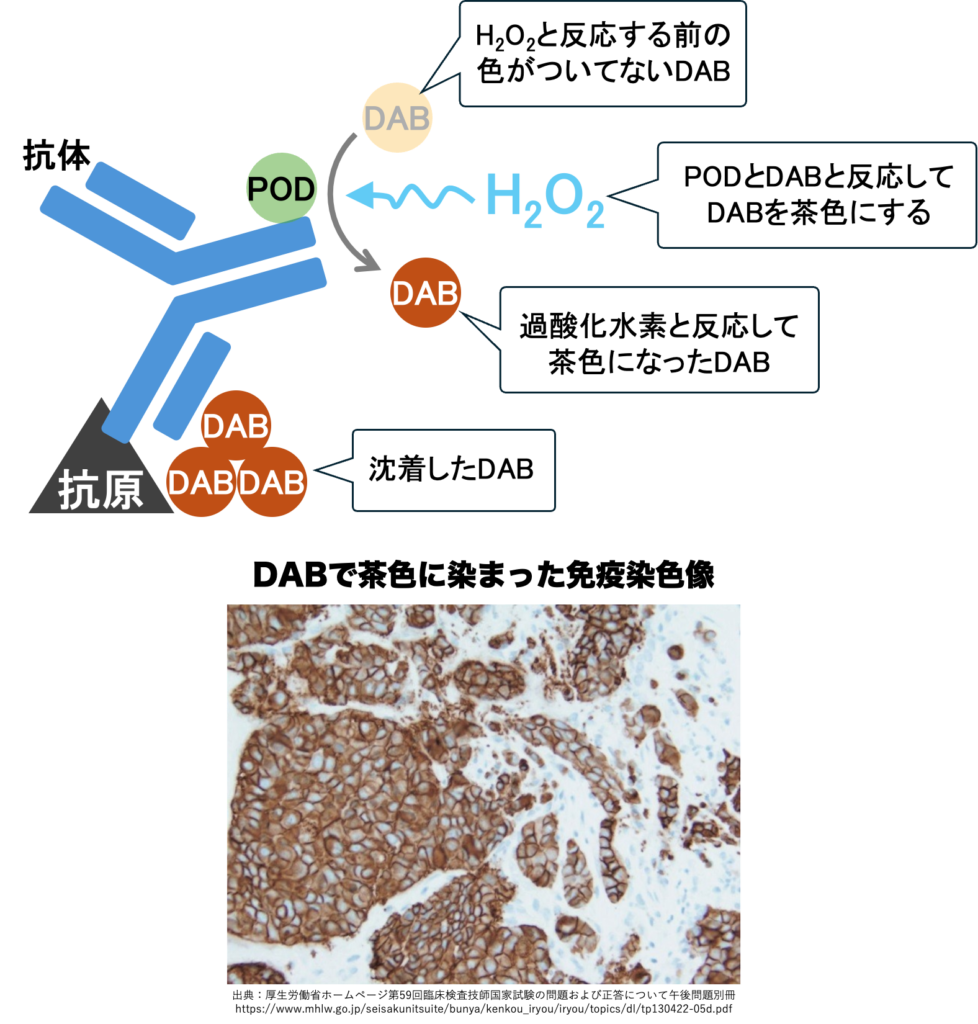
抗体に酵素を付けておくと、その酵素に”基質“が反応して発色します。
反応した基質は抗原周辺に溜まり、抗原に色が付いたように見えます。

このように抗体に酵素を結合させた免疫染色方法を“酵素抗体法”と呼びます。
この酵素と基質はある程度組み合わせが決まっています。
使用する酵素と基質によって以下の重要ポイント5つは必ず覚えておきましょう。
❶酵素名
❷対応する基質名
❸発色後の色
❹用いる封入剤
❺永久標本になるかどうか
(下の表にまとめたのでぜひ使ってください)
| 酵素 | POD | ALP | |
|---|---|---|---|
| 基質 | DAB | AEC | ファスト赤など |
| 反応原理 | 酸化 | 酸化 | 加水分解 |
| 発色後の色 | 茶色 | 赤色 | 赤色 |
| 封入剤 | 非水溶性 | 水溶性 | 水溶性 |
| 永久標本 | なる | ならない | ならない |
ALP:アルカリホスファターゼ
DAB:ジアミノベンチジン
AEC:アミノエチルカルバゾール
ペルオキシダーゼ(POD)による発色は、基質だけでなく過酸化水素(H2O2)も必要です。
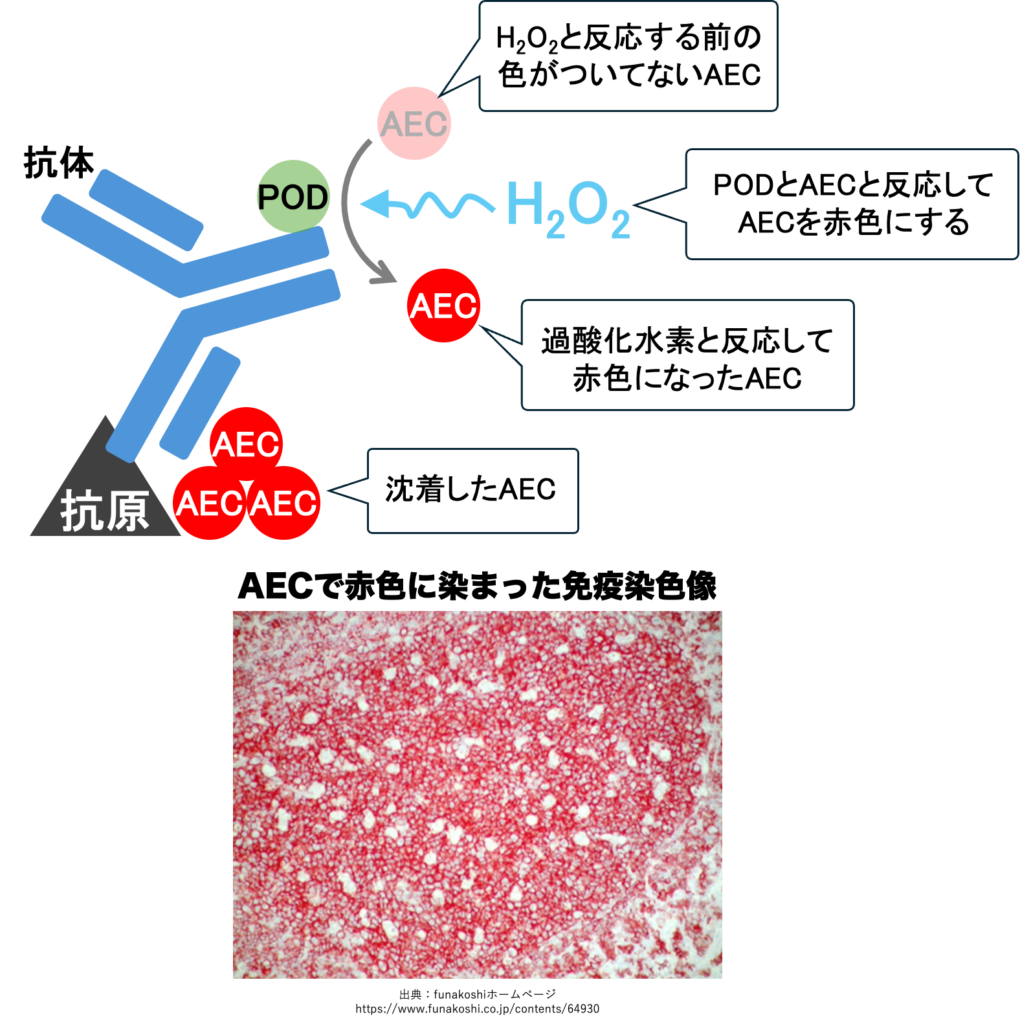
基質にAECを用いた免疫染色の反応と実際の組織像
組織には最初からペルオキシダーゼやアルカリホスファターぜが存在します。
この体内にすでにある酵素を【内因性酵素】と呼びます。
酵素抗体法で免疫染色をするときは内因性酵素を除去する必要がある。
内因性ペルオキシダーゼと内因性アルカリホスファターゼを除去する試薬は異なり、試験にも出題されやすいので覚えておきましょう。
【酵素抗体法まとめ】
- 酵素抗体法は酵素と基質を使って発色する方法の総称
- 酵素はペルオキシダーゼかアルカリホスファターゼ
- ペルオキシダーゼの基質はDABかAEC
- アルカリホスファターゼの基質はファスト赤など
- DABは茶色、非水溶性封入剤、永久標本になる
- AECは赤色、水溶性封入剤、永久標本にならない
- 抗体反応前に内因性酵素の除去が必要
●蛍光抗体法〜蛍光と蛍光顕微鏡で発色する〜

第68回臨床検査技師国家試験の問題および正答について 午前問題別冊(https://www.mhlw.go.jp/seisakunitsuite/bunya/kenkou_iryou/iryou/topics/dl/tp220421-07a_02.pdf)
蛍光色素を使って発色する方法は【蛍光抗体法】と呼ばれます。

蛍光色素は単体でも少しは光って見えますが、しっかり光らせるために励起光を当てます。
この励起光を当てられる顕微鏡を【蛍光顕微鏡】と呼びます。

- 欠点
- 蛍光顕微鏡が必要
- 背景が暗い
(全体像が見えない) - 永久標本にならない
(退色する) - 電顕に応用できない
- 利点
- 感度が高い
- 内因性酵素の影響を受けない
(ブロッキングが不要) - 発色操作が不要
- 賦活化が不要
(主に凍結切片を使うため) - 基本直接法で行うため操作が簡便
蛍光色素は抗体に結合させるものと核を染めるための2種類があります。
それぞれが❶どこに結合するのか❷発色する色の2つを覚えましょう。
- 抗体に結合させる蛍光色素
- FITC(緑黄色)
- Cy3(赤橙色)
- Texas red(赤色)
- 核に結合させる蛍光色素
- DAPI(青)
- Hoechst(青)
- Propidium iodide(赤)
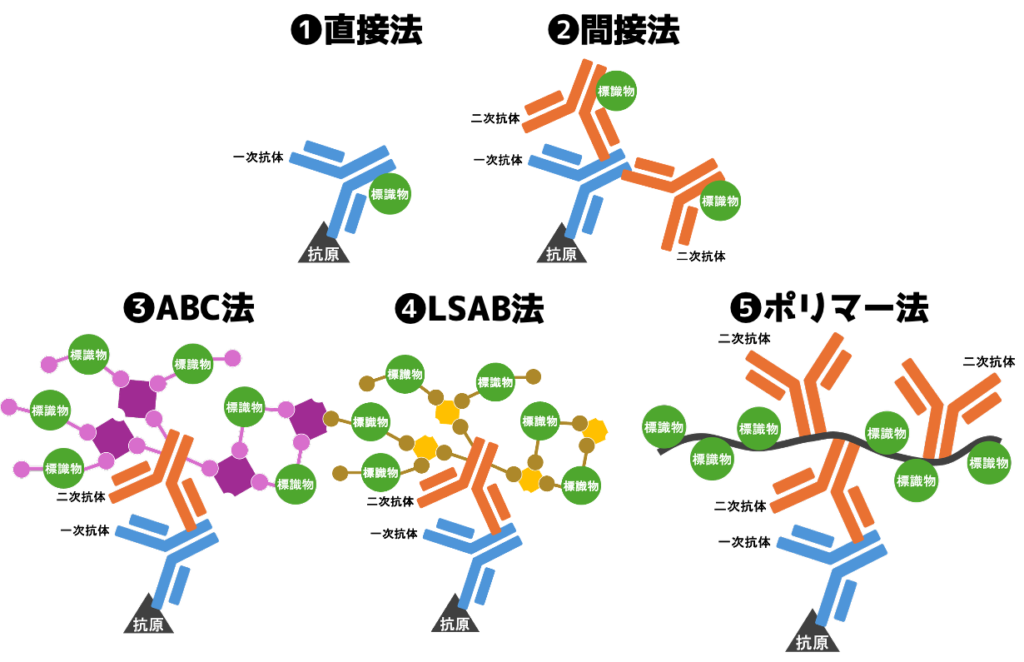
❷抗体の数で直接法と間接法に分ける
免疫染色には使われる抗体の数によって2種類に分けます。
- 抗体を1つ使うもの
直接法 - 抗体を2つ以上使うもの
間接法
直接法は特異度が高く、感度が低い
直接法は標識物質が付いた抗体を抗原に直接結合させる方法。
抗原に結合する抗体を一次抗体と呼びます。
「直接法は一次抗体に標識物質が付いている」と言えます。

抗体にくっ付いているもの。
具体的には酵素や蛍光色素のこと。
- 間接法に比べて感度(小さいものを見つける能力)が低い
- 間接法に比べて特異度(目的物質だけ検出する能力)が高い
間接法は感度が高く、特異度が低い
間接法は抗原に一次抗体を結合させた後、さらに標識物がついた抗体をくっ付ける方法。
一次抗体に結合する抗体を二次抗体と呼びます。
「間接法は二次抗体に標識物質が付いている」と言えます。

- 直接法に比べて感度(小さなものを検出する能力)が高い
- 直接法に比べて特異度(目的物質だけ検出する能力)が低い
- 感度が高い理由
一次抗体には二次抗体を複数結合させることができるため色がつきやすい。色がつくと目で見やすい。これが感度の高さとなる。 - 特異度が低い理由
間接法では抗体を結合させる回数が増える。工程が増えるとミス(本来結合した部位ではない部分への結合)が起きやすくなる。つまり特異度が低くなる。
二次抗体は一次抗体と違う動物を使う
二次抗体は一次抗体とは異なる動物種の抗体を用います。
一次抗体がウサギで作られた場合、二次抗体はウサギ以外の動物(例えばヤギやマウス)で作られる。
同じ動物種(ウサギ)では免疫寛容(自分に対して反応しないなど)が働き、自己抗体が作られにくいため、他の動物由来の抗体となる。
❸感度の上げ方で5種類に分ける
標識物質をたくさん付ければ、目的物質が検出しやすくなります(感度が高くなる)。
この感度を上げる方法が以下の5つです。
- ABC法
- LSAB法
- (高分子)ポリマー法
- PAP法
- CSA法

今回はこの中でもよく使われる
❶ABC法
❷LSAB法
❸(高分子)ポリマー法
の3つを詳細解説。
ABC法(アビジン・ビオチン コンプレックス法)
アビジンとビオチンの非常に強力にくっ付く力を利用した方法。
この結合力は抗原抗体反応よりもはるかに高く、不可逆的である。
酵素などの標識物がたくさんあるため、感度を上げることができる。
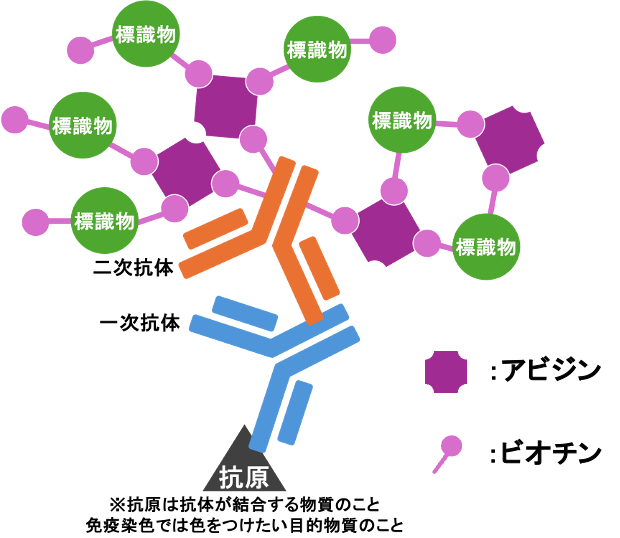
- アビジン
卵白などに含まれる塩基性の糖蛋白。4つのビオチン結合部位があり、ビオチンと強力な結合が可能。 - ビオチン
水溶性ビタミンのビタミンB7(別名:ビタミンH)のこと。体内にも存在する。アビジンと強力な結合が可能。
- 直接法、間接法より感度が高い
- 内因性ビオチンのブロッキングが必要
- LSAB法より非特異的反応が多い
- LSAB法より分子量が大きく浸透力が悪い
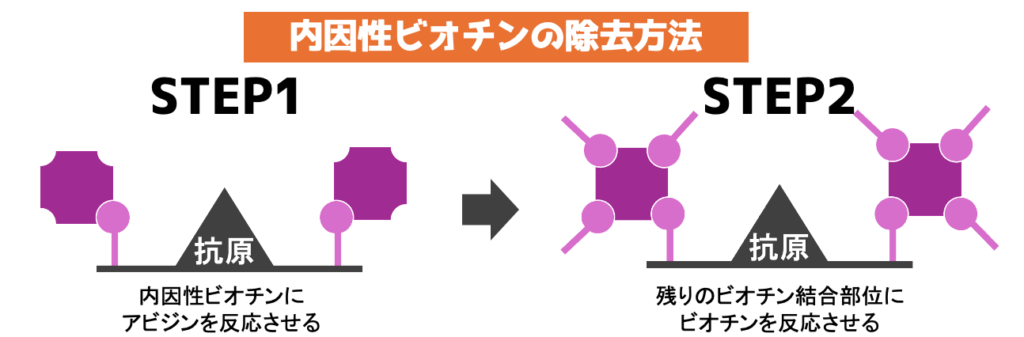
内因性ビオチンの除去はアビジンとビオチンを使う
内因性ビオチンとはもともと体の中にあるビオチンのことです。
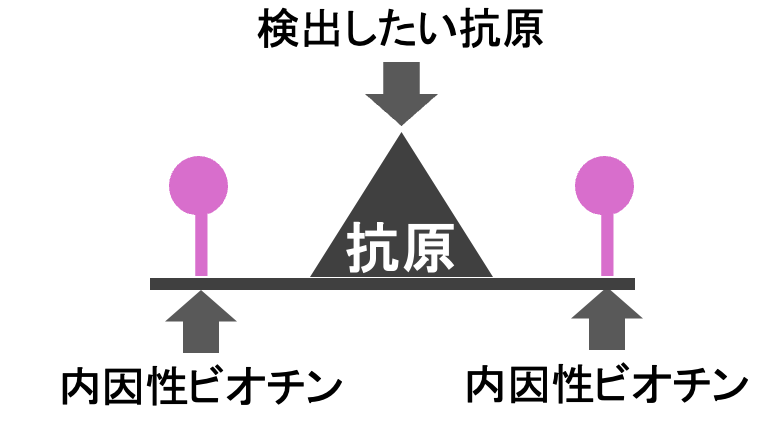
この内因性ビオチンがABC法やLSAB法の時に反応してしまうため、事前に除去する必要がある。
下画像のように事前にアビジンとビオチンを反応させれば除去できます。
LSAB法(ラベルド・ストレプトアビジン・ビオチン法)
ABC法と似た方法。
ABC法がアビジンを用いるのに対し、LSAB法ではストレプトアビジンを用いる。
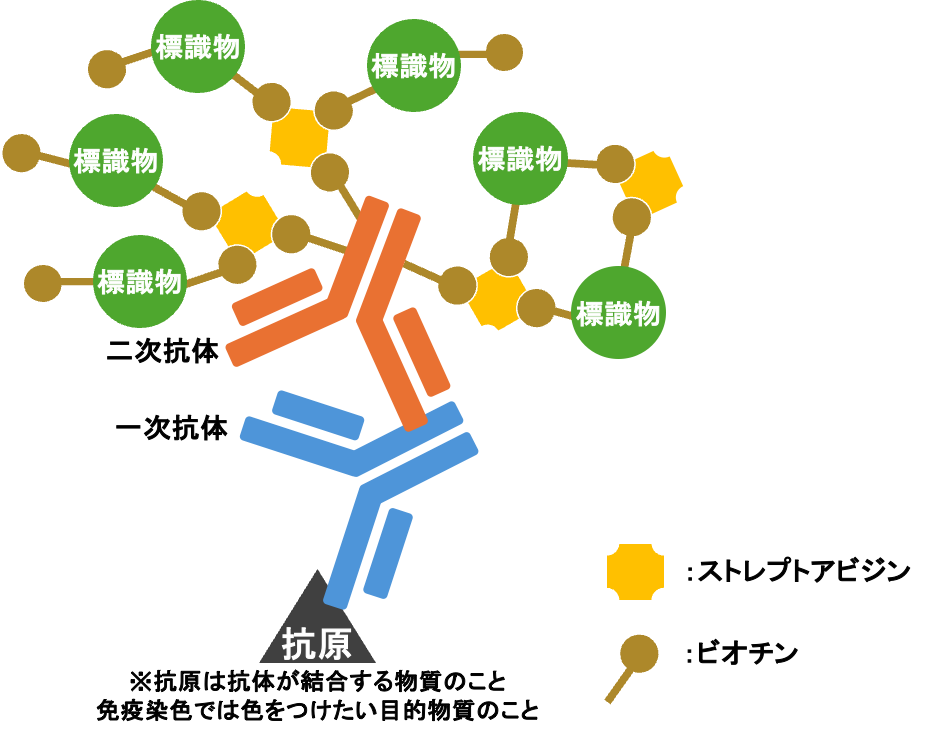
放線菌の一種であるStreptomyces avidiniiから得られるアビジン様のタンパク。通常のアビジンと比較して❶非特異的反応が少ない❷分子量が小さいため浸透力が良いなどの違いがある。
- ABC法より感度が高い
- 内因性ビオチンのブロッキングが必要
- ABC法より非特異的反応が少ない
- ABC法より分子量が小さく浸透力が良い
ポリマー法(高分子ポリマー法)
高分子ポリマーにたくさんの標識物質が付いた高感度な免染方法。
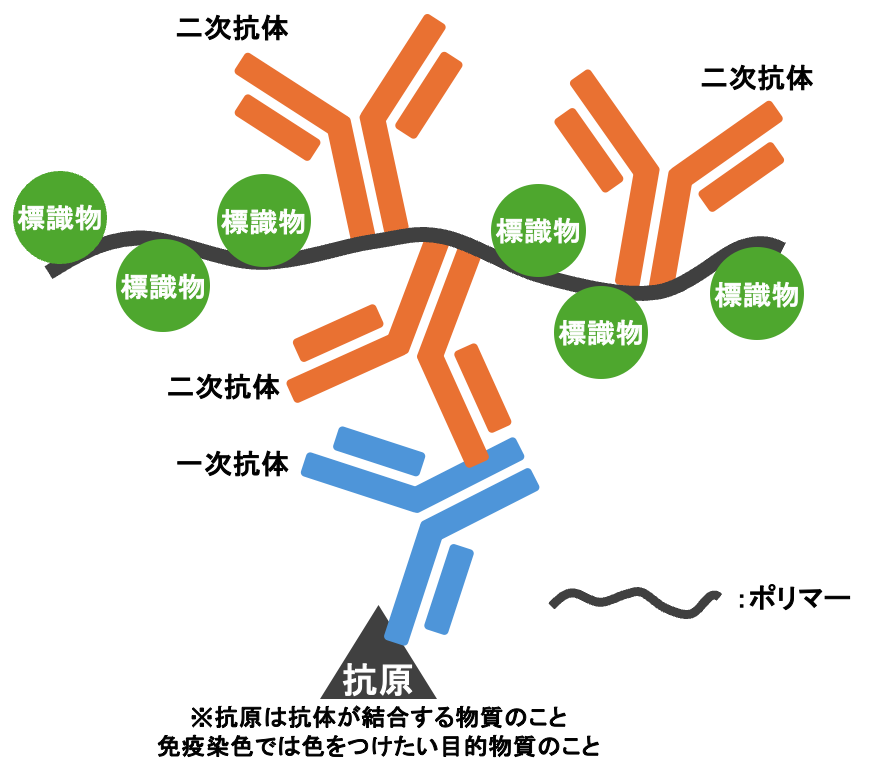
デキストラン(多糖類の一種)やアミノ酸(タンパク質)など、モノマーが多数連なってできた分子量の大きな化合物。免疫染色では、こうした高分子ポリマーに酵素や二次抗体を多数結合させた「ポリマー試薬」が用いられ、シグナル増幅や高感度検出ができる。
一次抗体と二次抗体をもう一つの抗体(ブリッジ抗体)追加する3ステップポリマー法もあり、2ステップよりも感度が高い。
上の画像は2ステップポリマー法を想定している。
- LSAB法より感度が高い
- ABC法やLSAB法より染色工程が少ない
- 内因性ビオチンのブロッキングが必要ない
- 分子量が大きく浸透が悪い
※最近は分子量の小さい浸透が良いものもある
7つの免疫染色と感度の順番
- 直接法
- 間接法
- PAP法
現在はあまり使われない方法であるため原理などは知らなくても良い。 - ABC法
- LSAB法
- ポリマー法
- CSA法
ビオチン標識タイマライドを用いる超高感度な方法。
これらの方法を感度順に並べると以下のようになる。
直接法<間接法<PAP法<ABC法<LSAB法<ポリマー法<CSA法
免疫染色まとめ
【原理別】免疫染色法比較表
| 方法名 | キーワード | メリット | デメリット |
|---|---|---|---|
| 直接法 | 一次抗体+標識物 | 工程が最短 特異性が高い | 感度が低い |
| 間接法 | 一次+二次抗体 | 感度が向上 汎用性が高い | 工程が増える 非特異反応のリスク |
| ABC法 | アビジン・ビオチン | 高感度 | 内因性ビオチン対策が必要 |
| LSAB法 | ストレプトアビジン | 低バックグラウンド 高S/N比 | 内因性ビオチン対策が必要 |
| ポリマー法 | 高分子ポリマー | 現在の主流 超高感度 工程が簡便 | 浸透性が課題になる場合も (改良品あり) |
酵素抗体法 VS 蛍光抗体法
| 酵素抗体法 | 蛍光抗体法 | |
|---|---|---|
| 標識物 | 酵素 | 蛍光 |
| 顕微鏡 | 光学顕微鏡 (明視野顕微鏡) | 蛍光顕微鏡 |
| 背景 | 明るい 腫瘍の範囲など観察可 | 暗い 腫瘍の範囲などは観察しづらい |
| 発色操作 | 必要 | 不要 |
| 内因性酵素除去 | 必要 (除去物質は原理による) | 不要 |
| 抗原賦活 | 基本的には必要 | 基本的には不要 (直接法が多いため) |
| 永久標本になるか | なる (特にDAB) | ならない |
| 電顕への応用 | 可能 | 不可能 |
| 二重染色 | 可能 | 可能 |
