【凍結切片】作製法・使用試薬・アーチファクトから免疫染色との関連まで徹底解説!


この記事では凍結切片の試験に出る部分を紹介します。
凍結切片標本は検体を凍結して薄切する
検体を液体窒素やドライアイスなどで凍結して固めてから薄切する方法。
通常のパラフィン固定標本と比べると生の状態に近いため、組織中の成分が残りやすい。
標本作製にかかる時間も短い。
標本作製するためには薄切をする必要があり、薄切するためには硬いもので固める必要がある。
薄切のイラスト解説はこちら
通常の組織切片はパラフィンで組織を固めることで薄切を可能とする。
凍結切片では凍結させることで組織を一時的に固めて、薄切を可能とする。
凍結切片とホルマリン固定パラフィン包埋切片の違い
通常の標本作製はホルマリン固定パラフィン包埋を行います。
ホルマリン固定のイラスト解説はこちら
パラフィン包埋のイラスト解説はこちら
凍結とホルマリン固定パラフィン包埋にはそれぞれ利点と欠点があり、状況に応じて使い分けます。
| 凍結 | ホルマリン固定 パラフィン包埋 | |
|---|---|---|
| 脂肪染色 | できる | できない |
| 抗原性 | 保持しやすい | 保持しにくい |
| 標本作製時間 | 短い | 長い |
| 硬組織の薄切 | 切れない | 切れる(脱灰後) |
| ブロックの 長期保存 | できない | できる |
凍結切片は脂肪染色に向いている
凍結切片作製はアルコールを使わずに行えるため脂肪染色が可能です。
ホルマリン固定パラフィン包埋切片ではアルコールが必要であるため脂肪染色ができません。
アルコールは脂肪を溶かす作用があり、アルコールを使うことで検出したい(染めたい)脂肪成分がなくなってしまうため染色できない。
脂肪染色のイラスト解説はこちら
凍結切片は抗原性が保持される
組織には多くの蛋白(抗原)が存在し、それを免疫染色などで検出することがあります。
免疫染色のイラスト解説はこちら
しかし、ホルマリン固定パラフィン包埋では固定や加熱により抗原性の低下が見られます。
凍結切片はそれらが無いため、抗原性が保持されやすいです。
- ホルマリンによるメチレン架橋が生じない
メチレン架橋の解説はこちら - 加温しない
蛋白である抗原は熱に弱いため
凍結切片は作製時間が短い
凍結切片は数十分で標本作製が可能です。
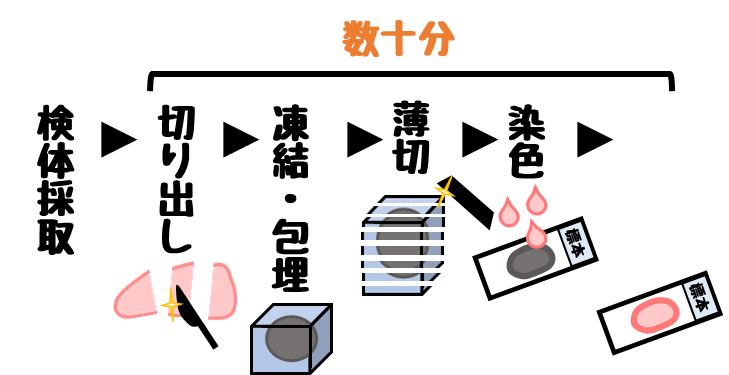
ホルマリン固定パラフィン包埋の作製は数日かかることが多いです。
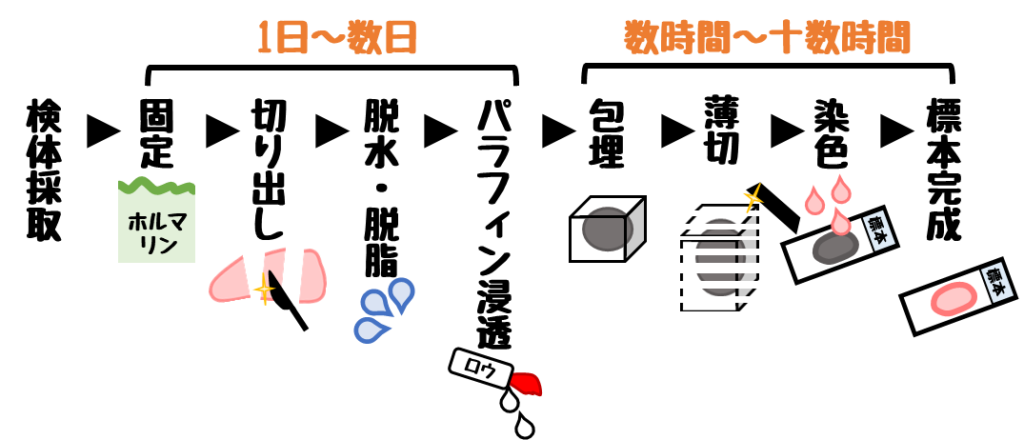
凍結切片の作製時間が短いという利点から、術中迅速診断に有用です。
手術中に採取した検体をすぐに標本化し、短時間(30分以内程度)で診断を報告する業務。
腫瘍の良悪性の判定や、がんの広がり、切除断端に腫瘍が残っていないかなど、手術の方針や範囲をその場で決定する。
2種類の凍結切片作製法
- 固定前凍結切片作製法
固定をする前に標本を作製する方法 - 固定後凍結切片作製法
固定をした後に標本を作製する方法
固定前凍結切片作製法の利点と欠点
この方法は生の臓器を包埋し薄切まで行います。
切片作製まで時間が短いため術中迅速診断時に使います。
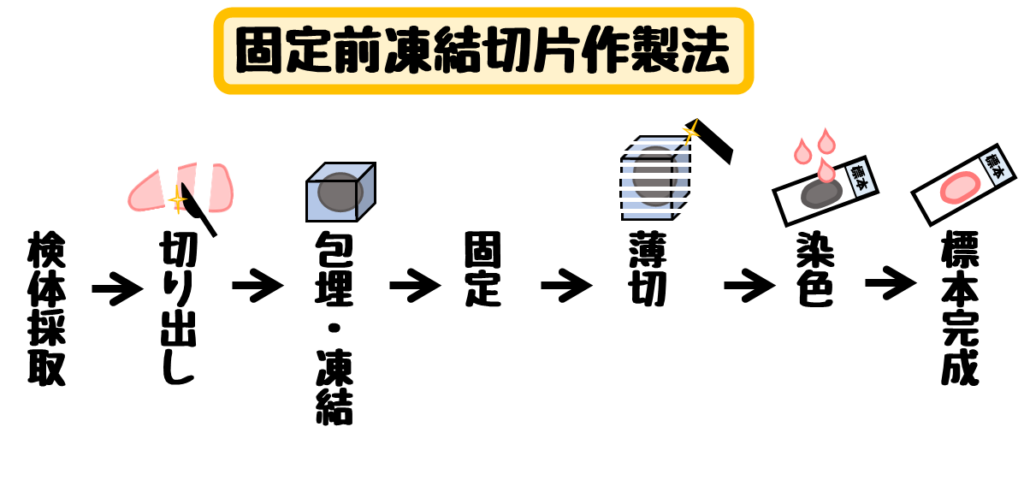
固定しないことから抗原性も保持され、免疫染色でも使われる。
固定しないことで組織構造の保持が悪いという欠点もあります。
- 利点
- 処理時間が短いため術中迅速に使われる
- 抗原性が保持されるため免疫染色に有効
- 欠点
- 最初に固定しないため組織構造の保持が悪い
- 鏡検時に構造が壊れて見える時がある
固定後凍結標本作製法の利点と欠点
この方法は固定した臓器を凍結して処理します。
固定に時間がかかるため術中迅速診断には適応できません。
また、スクロースで固定液を洗浄する操作も加わるため、さらに時間がかかります。
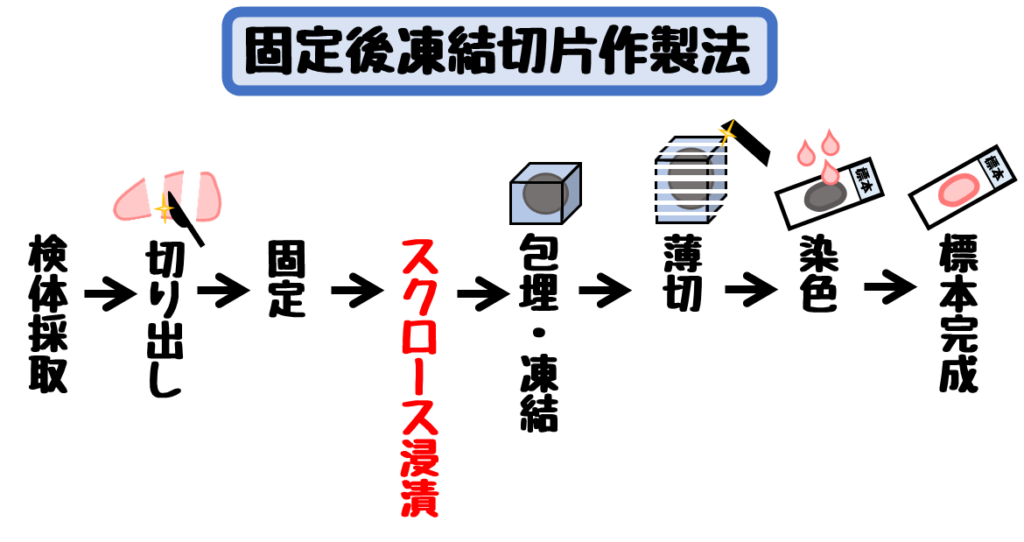
最初に固定を行うため組織構造保持に優れています。
つまり顕微鏡で見るときにちゃんと構造が保たれた状態で観察できます。
事前にホルマリンなどで固定を行う脂肪染色にも有効です。
- 利点
- 固定を行うため組織構造の保持に優れる
- ホルマリン固定後の脂肪染色時に有効
- 欠点
- 時間がかかる
- スクロースによる固定液洗浄が必要
凍結切片作製法(術中迅速診断用標本作製)の手順
ここでは頻度の高い「固定後凍結標本作製」を確認します。
固定前作製法と術中迅速診断の凍結標本作製は同様だと認識してください。

凍結切片作製時の切り出し時は感染しやすい
ホルマリン固定した場合は固定時に多くの感染性が失われます。
凍結切片作製時は未固定(生)の状態で切り出し行うため、感染性が残っています。
そのため、通常よりも感染対策を入念に行う必要があります。
凍結切片作製時の包埋は水溶性包埋剤を使う
包埋とは組織を薄切できるように固める作業のことです。
パラフィン包埋の解説はこちら
凍結切片時に使う包埋剤は水溶性を使います。
- OCTコンパウンド
- カーボワックス
- ゼラチン

【包埋剤】と【封入剤】は違うものなので注意してね!
【凍結切片】【術中迅速】などの単語が出たら水溶性包埋剤を使うと覚えておこう!
凍結は液体窒素やドライアイスで行う
組織を包埋剤の中に入れた後は急速に凍結します。
この急速凍結が重要です。
凍結に使うものは主に2種類あります。
- 液体窒素
- ドライアイスを加えたアセトン、エタノールなど
※現在は専用の装置もあり、上のものを使わないこともある。
包埋した組織をこれらの液に浸けます。
凍結する際は急速凍結する必要があります。
ゆっくり凍結すると氷晶が形成され組織が障害されるため。
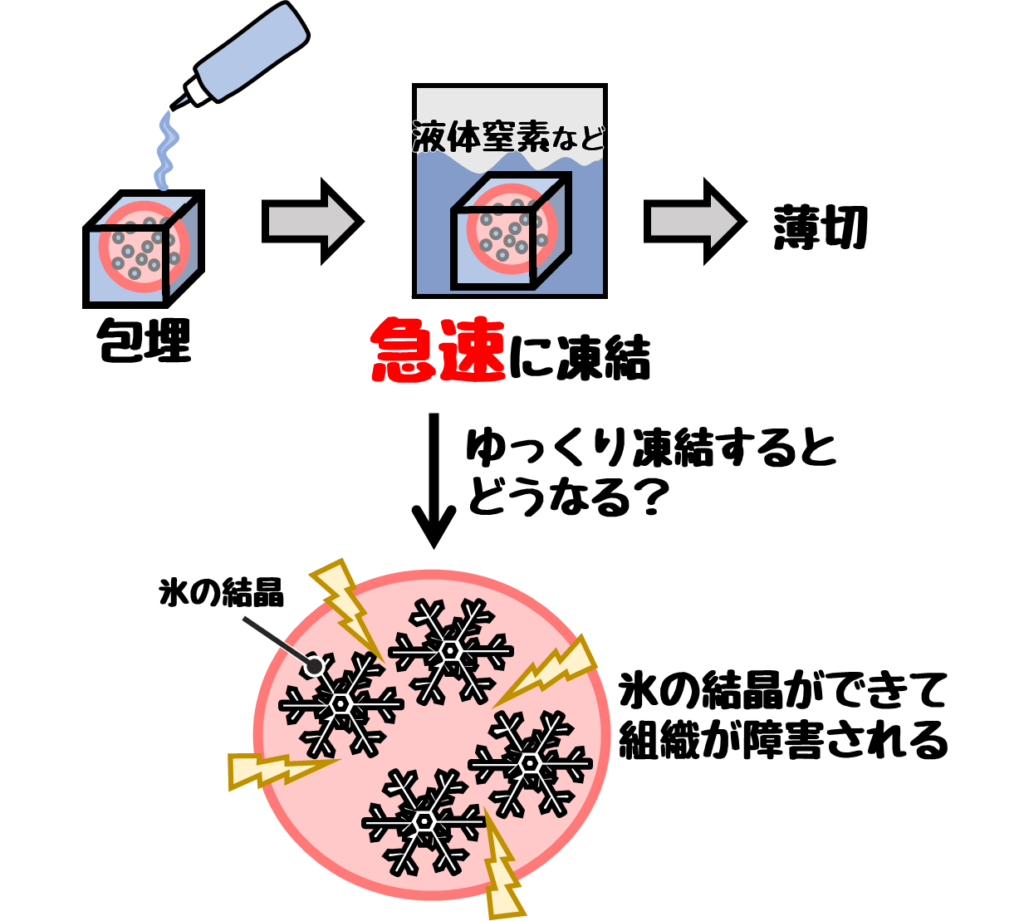
ゆっくり凍結すると、下画像のように核内や細胞質の空胞が生じます。
https://www.mhlw.go.jp/seisakunitsuite/bunya/kenkou_iryou/iryou/topics/dl/tp200414-07b_02.pdf
凍結切片の薄切はクリオスタットを使う
凍結切片作製時の薄切は冷たい場所で行う必要があります。
冷たい場所で使えるミクロトームをクリオスタットと呼び、これで薄切します。
ミクロトームが冷たい箱の中に入っているようなイメージです。
- 庫内は-20℃程度
- 脂肪組織は-35℃以下が薄切しやすい
- 厚め(4~8μm)で切る
- ミクロトームの種類は回転式のミノー型
ミクロトームの種類の解説はこちら - オゾン処理や薄切屑の吸引装置などの感染防止機能がある
- 脂肪組織
凍結切片作製時は脱脂を行わないため脂肪組織は切りにくい。 - 硬組織
凍結切片作製時は脱灰を行わないため硬組織は切れない。
凍結切片の”しわ”はブロックの温度が高い
温度が高いと、組織が軟らかすぎて、刃が当たった際に組織が圧縮され、”しわ”が生じたり、脂肪部分が抜けることがあります。
- 原因
ブロックの温度が高い - 解決策
冷却スプレーでブロック温度を下げる
凍結切片の”細かいひび割れ”はブロックの温度が低い
温度が低いと組織が硬くなりすぎ、もろくなるため、切片が粉々になったり、割れたり(ひび割れ)することがあります。
- 原因
ブロックの温度が低い - 解決策
指の腹を当ててブロック表面の温度を上げる
凍結切片薄切後の固定はアルコールが主体
薄切前に固定しない場合は薄切後に固定します。
固定方法は2種類に分かれます。
- 湿潤固定
切片を30〜60秒浸ける。以下の3つに有効。- 術中迅速診断
アルコールベースの固定液を使う - 脂肪染色
10%ホルマリン - 免疫染色
各抗原に適した固定液
- 術中迅速診断
- 乾燥固定
切片を冷風乾燥する。- 免疫染色
凍結切片が有効な染色はHE染色、脂肪染色、免疫染色
凍結切片の固定後は目的に応じた染色を行います。
凍結切片は特に以下の3つに有用です。
- 術中迅速診断時はHE染色
- 脂肪の検出には脂肪染色
脂肪染色の種類はこちら - その他免疫染色など
免疫染色のイラスト解説はこちら





