免疫染色 不良標本 の原因とその対処法4選

みんなの病理の点数を上げる臨床検査技師、細胞検査士のどっとゼブラです!
今回は苦手な人が多い免疫染色の 不良標本 対処法ついて解説していきます!
今回も頑張ろう!
https://note.com/dot_zebra/n/nd89c4e3fb6bd
- 免疫染色を理解したい人
- 国家試験の点数アップを狙う人
- 模試でも点を取りたい人
免疫染色 不良標本 に関する問題
Q.免疫染色(PAP法)で陽性コントロールの染色性が低下した。対処法はどれか。
- 内因性ペルオキシダーゼ不活化時間を長くする
- 一次抗体を濃くする
- 一次抗体反応後の洗浄を長くする
- 二次抗体の反応時間を短くする
- DABの反応時間を短くする
こんな問題を理解できるようにしていこう!
免疫染色 不良標本 の種類
免疫染色 不良標本の種類は主に4つあります。
- 切片が剥離する
- 染色性が弱い
- バックグラウンド(非特異的反応が強い)
- 染色ムラがある
今回はこれらの解説をしていきますが、基礎知識が無いと理解が難しいです。
「免疫染色が全く分からない」
という人は基礎の記事を見てみてください。
【臨床検査技師国家試験対策】免疫染色を分かりやすくイラスト解説①酵素抗体法と蛍光抗体法
【臨床検査技師国家試験対策】免疫染色を分かりやすくイラスト解説②直接法、間接法、ABC法、LSAB法、ポリマー法
【臨床検査技師国家試験対策】免疫染色の抗原賦活化とブロッキングをわかりやすくイラスト解説
【検査技師国試対策】これで完結!免疫染色の各工程をイラストで理解して完全制覇!
まずはこれらの記事で見てみてね(^^)
不良標本 ①切片が剥離する
ここからは原因と具体的な解決策を書いていきます。
原因①脱脂・脱水・パラフィン浸透不足
脱水・脱脂・パラフィン浸透を十分行う
組織の免疫染色は薄切切片に行います。
薄切切片とはパラフィン包埋したブロックを薄く切ったものです。
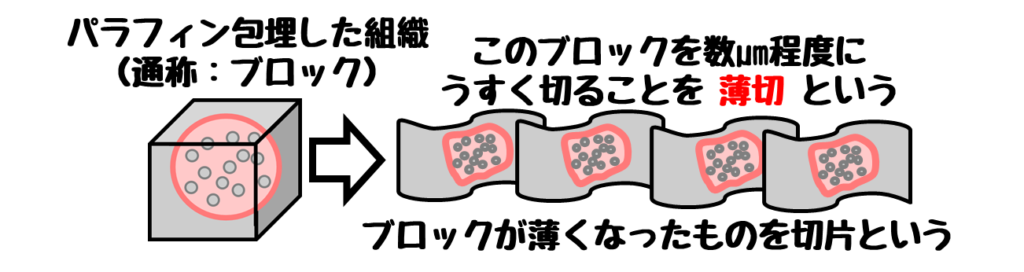
この切片を作るために次のような工程が必要です。
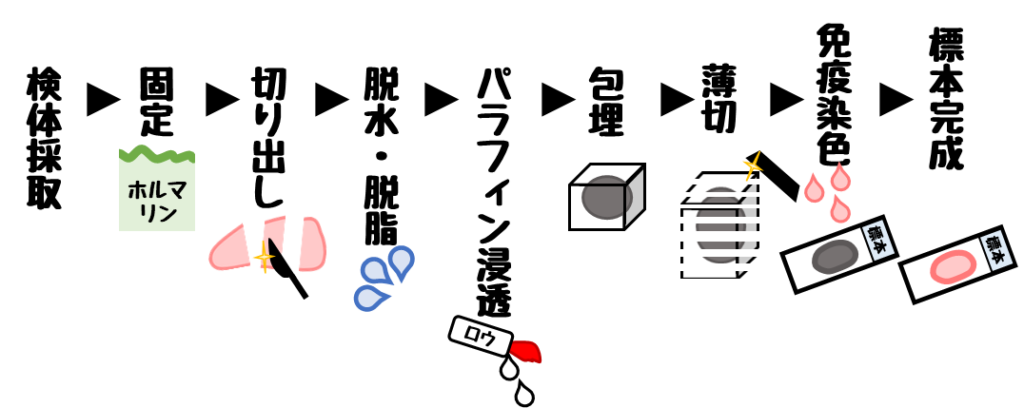
包埋以前の操作に注目してみましょう。
脱水・脱脂・パラフィン浸透があります。
この操作が不足している場合いい切片が作れません。
ガラスに貼り付けても剥がれる。
もしくはそもそも切れないなどの問題が起きます。
原因②剥離防止コートスライドを使用していない
コートスライドを使用する
切片は最終的にガラスに貼り付けます。
そのガラスにも種類があり、免疫染色にはコーティングガラスが最適です。
何のためにコーティングして何をコーティングしてるんだ?
コーティングは剥離防止のために行われます。
コーティングの種類は様々なものがあります。
例として松波硝子のHPを紹介するね。
コーティングについて詳しく知りたい人はこちら
原因③切片が厚い
適切な切片厚(3~4µm)で薄切する
切片が厚いとガラスから剥がれやすくなります。
適切な切片の厚さ(3~4µm)で切るとはがれにくくなります。
原因④抗原賦活化による剥離
- 最適な条件を設定する
- コートスライドを使う
抗原賦活には熱や酵素を使うんだったな
熱をかけたり酵素処理すると剥がれやすくなります。
剥がれず処理できる最適な条件を検討する必要があります。
コートスライドを使ってない場合、それを使うと解決できることもあります。
不良標本 ②染色性が弱い
原因①抗体濃度が薄い
抗体の濃度を上げる
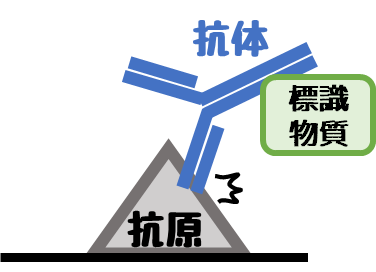
免疫染色は抗原に抗体を付ける必要があります。
この抗体の濃度が低い(数が少ない)とくっ付く確率が下がります。
染色性が弱い時は抗体の濃度を上げてみましょう。
原因②抗体反応時間が短い
抗体反応時間を長くする
抗体反応時間が短いのも抗体がくっ付きにくくなります。
染色性が弱い時は反応時間を長くしてみましょう。
原因③抗体や標識物質の失活
新しい抗体、標識物質を使う
使用する抗体や標識物質が使えなくなっている場合があります。
その場合は新しいものに変えるしかありません。
標識物質ってなんだっけ?
抗体に付ける物質のこと。
酵素とか蛍光とかがあるよ。
抗体に付くもので染色の名前も変わります。
復習したい人はこちら⇊
【臨床検査技師国家試験対策】免疫染色を分かりやすくイラスト解説①酵素抗体法と蛍光抗体法
原因④抗原性の低下
再薄切、再検体採取などを行う
抗原性ってなに?
抗原性とは
抗原が抗体とくっ付ける能力のこと
抗原性が下がると抗体とくっ付けなくなります。
つまり抗原性が弱まると染色性も弱まるってことだね。
その原因としては
- 切片ないしブロックの経年劣化
- 過固定
などが考えられます。
そのため、厳密な固定時間の管理や再薄切などの対処法が必要。
原因⑤抗原賦活化法が不適切
最適な賦活化法を検討する
抗原賦活化法が不適切だと抗原が壊れたり賦活されなかったりします。
そうすると抗体が付かず染色性が弱くなります。
不良標本 ③バックグラウンド(非特異的反応)が強い
原因①切片が乾燥している
常に湿潤状態にして乾燥を防ぐ
乾燥すると関係ない部分にも抗体が付きます。
なので常に湿った状態にしておく必要があります。
そのために湿潤箱の中で操作するんだな
原因②ブロッキングをしていない
非特異的反応のブロッキングを行う
関係ない部分が染まるのを防ぐやり方があります。
それを【非特異的反応のブロッキング】と呼びます。
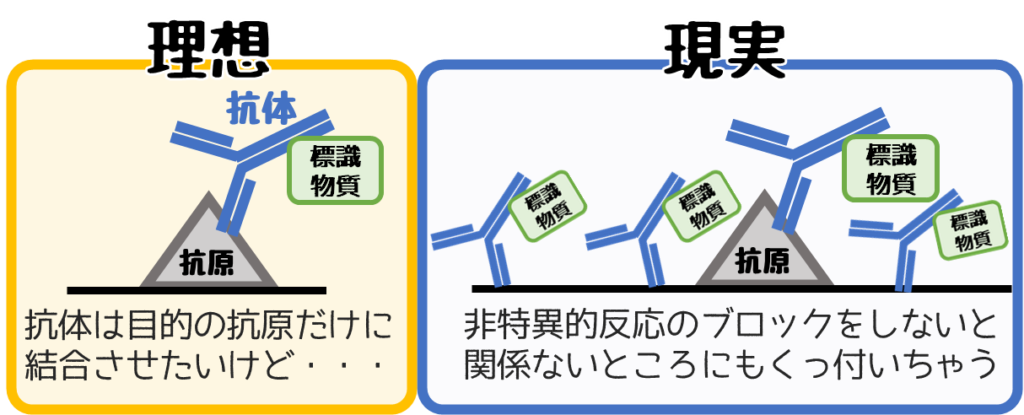
上イラストのように関係ない部分に染まるので
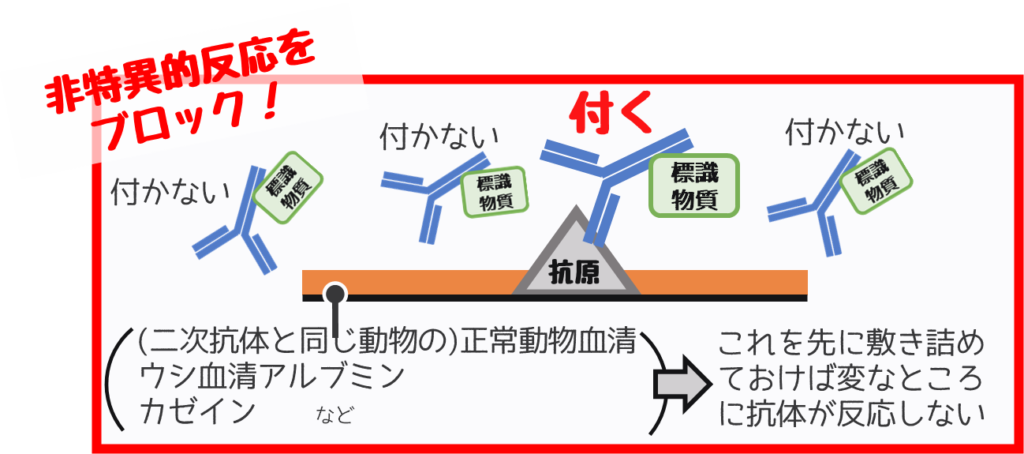
関係ないところにタンパクを敷き詰めて反応できなくします。
これでバックグラウンドを抑えることができます。
その他内因性ペルオキシダーゼ不活化の時間を長くするなどもバックグラウンドを抑えます。
原因③抗体の濃度が高い
抗体の濃度を下げる
抗体の濃度が高いと関係ない所にも付く可能性が上がります。
なので関係ない部分にも染まっている場合は抗体をより希釈します。
原因④発色時間が長い
発色時間を短くする
発色時間が長いと関係ない部分にも色が付きます。
発色時間・・・?
酵素抗体法では発色が必要です。
発色とは過酸化水素とDABを入れて色を付けることだね。
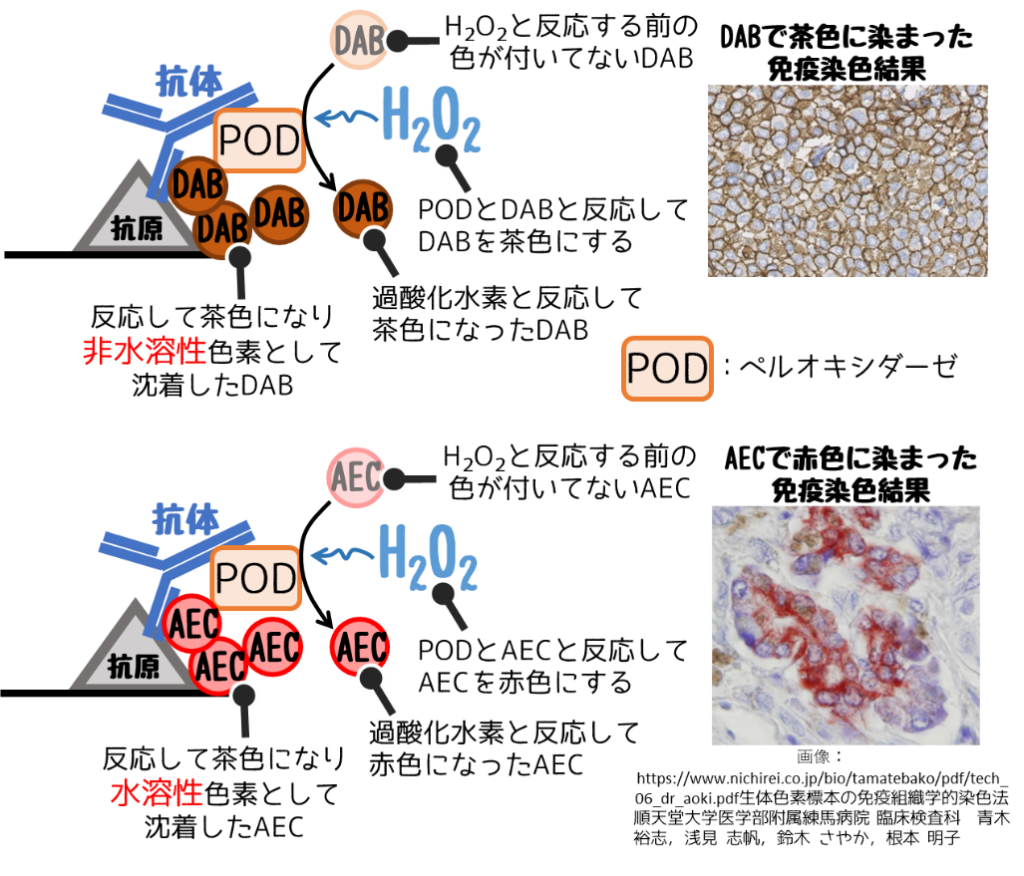
この過酸化水素とDABを反応させる時間を発色時間と言います。
この時間が長いと背景や関係ない部分まで染まります。
染まりすぎる場合はこの時間を短くします。
原因⑤洗浄が不十分
PBS洗浄を十分に行う
免疫染色の洗浄はPBSで行います。
この洗浄は余分な抗体などを洗い流す役割です。
洗浄が不十分だと余分な抗体が残ります。
その抗体に反応して関係ない部分が染まるので十分に洗う必要があります。
不良標本 ④染色ムラがある
原因①試薬が全体にかかっていない
試薬をまんべんなくかける
試薬がまばらにかかるとムラができます。
原因②洗浄が不十分
PBS洗浄を十分に行う
洗浄が不十分な場合、無駄な抗体がまばらに残りムラになります。
原因③滴下した試薬に気泡がある
気泡があれば潰す
気泡がある場所は試薬がかかっていません。
気泡がある場所は染まらないってことか。
気泡はまばらに存在するので染色にムラができます。
原因④切片が部分的に乾燥
常に湿潤状態にして乾燥を防ぐ
乾燥してる部分が過剰に染まります。
乾燥していない部分は通常の染まり方をします。
その差がムラとなって出てきます。
最後に問題を確認
Q.免疫染色(PAP法)で陽性コントロールの染色性が低下した。対処法はどれか。
- 内因性ペルオキシダーゼ不活化時間を長くする
- 一次抗体を濃くする
- 一次抗体反応後の洗浄を長くする
- 二次抗体の反応時間を短くする
- DABの反応時間を短くする
答えは2だよ!
選択肢を一つずつ見ていこう!
1.内因性ペルオキシダーゼ不活化時間を長くする
背景の染まりが強い時に行います。
内因性ペルオキシダーゼのブロッキングは陽性コントロールの染色性と関係ないです。
2.一次抗体を濃くする
一次抗体が薄いと染色性が低下します。
そのため染色性が低下した場合は抗体濃度を濃くします。
3.一次抗体反応後の洗浄を長くする
洗浄を長くするのは染まりが強い時に行います。
洗浄はくっ付いてない余分な抗体などを洗い流す効果があります。
なので過剰な洗浄は余計反応が薄くなる可能性があります。
4.二次抗体の反応時間を短くする
抗体の反応時間を短くするのは染まりが強い時にします。
反応時間が短いと抗体がくっ付く可能性が下がります。
そのため染まりが強い時は反応を弱めるために時間を短くします。
5.DABの反応時間を短くする
DAB反応時間を短くするのは染まりが強い時にします。
DABは時間が長ければ長いほど染まりが強くなります。
つまり短くするということは色を薄くするということになります。
おわりに
今回の解説が必要な問題は出題頻度が少ないと思う。
ただ、考えれば分かる問題だから知らなくても解けるようになる。
みんなの1点に繋がると嬉しいです(^^)